

 B.
B.  C.
C.  D.
D. 
选项 | A | B | C | D |
强电解质 | HNO3 | NaCl | BaSO4 | 盐酸 |
弱电解质 | CH3COOH | NH3 | H3PO4 | Fe(OH)3 |
非电解质 | C6H12O6(葡萄糖) | CO2 | C2H5OH | H2O |
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |

酸 | 电离平衡常数 |
醋酸 | |
碳酸 |
|
亚硫酸 |
|
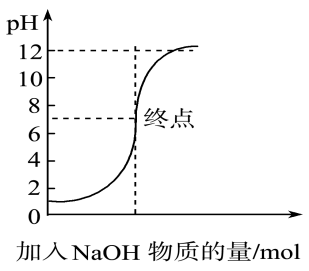
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
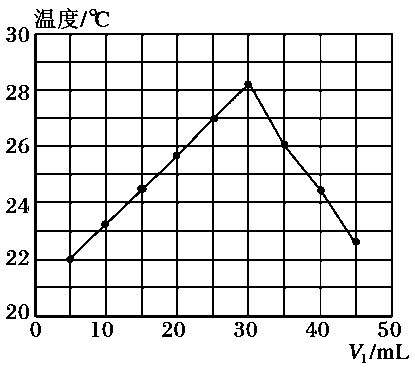
D.将物质的量浓度为m mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
请完成下列问题:
